【重磅】mRNA联合免疫疗法创奇迹 脑胶质母细胞瘤治疗进入新纪元
近日,西京医院临床免疫科、神经外科,空军军医大学国家分子医学转化中心、细胞生物学教研室,122cc太阳集成游戏生物,约翰斯·霍普金斯大学医学院药理学与分子科学系,杜克大学医学中心免疫学系的联合研究团队发表预印版论文,题为“Combination Immunotherapy of Glioblastoma with Dendritic Cell Cancer Vaccines, Anti-PD-1 and Poly I:C: A Case Report”(肿瘤mRNA-DC疫苗、抗PD-1和Poly I:C联合免疫治疗脑胶质母细胞瘤:一例病例报告)。提示该项研究对于联合免疫疗法在抗肿瘤治疗领域的前瞻性和指导意义。

该研究是全球范围内首次报告应用mRNA-DC疫苗、抗PD-1和poly I:C组成联合免疫疗法治疗IV期脑胶质母细胞瘤(GBM),并且达到预期目标:“最大限度地提高治愈的可能性”,最终患者超过5年的无进展生存期结果令人鼓舞。研究中应用全新的TriVac技术对mRNA编码的肿瘤抗原进行修饰,这也是mRNA技术优于多肽类疫苗的优势之一。在临床中TriVac技术修饰的mRNA表现出良好的安全性,并诱导出强大的抗肿瘤特异性CD4+和CD8+T淋巴细胞反应。该研究结果表明,联合免疫疗法可以长期进行,并且安全性和有效性也得到了验证,为有效治疗恶性程度极高的脑胶质母细胞瘤提供了新的临床治疗策略和实证支撑。研究中所用的抗肿瘤mRNA-DC疫苗由122cc太阳集成游戏生物研发,该产品已于今年10月18日获得国家药品监督管理局药品评审中心(CDE)受理临床试验申请,是国内首个治疗脑胶质母细胞瘤的mRNA-DC细胞疫苗,将为脑胶质母细胞瘤患者带来新的希望。
脑胶质母细胞瘤是中枢神经系统最常见的原发恶性肿瘤,因其恶性程度极高被称为“新癌王”。国家卫生健康委发布的《脑胶质瘤诊疗指南(2022年版)》显示:我国脑胶质瘤年发病率为5~8/10万,5年病死率极高,术后1年内高复发。脑胶质母细胞瘤作为一种起源于神经胶质细胞的肿瘤,约占所有中枢神经系统恶性肿瘤的80%,其发病率在全球范围内持续上升。近年来在脑胶质母细胞瘤的治疗上进展有限,患者的生存率很低,中位总生存期仅为13.5个月,是神经外科诊疗中最具挑战性的疾病。
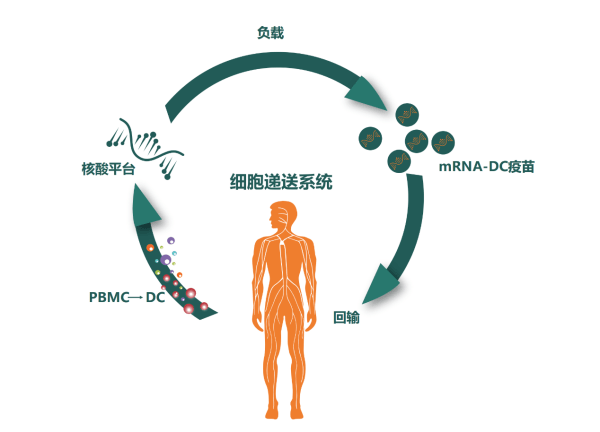
基于树突状细胞(DC)的肿瘤mRNA疫苗是一种非常有前途的GBM治疗方法。DC是目前已知体内抗原递呈功能最强的免疫细胞,也是特异免疫应答的启动器,能高效摄取、加工、处理并呈递抗原,是唯一能够激活初始T细胞的专职抗原递呈细胞,处于人体免疫应答的中心环节,因此被广泛应用于癌症治疗。
该预印本文章报道的临床研究,采用患者自体DC细胞装载多种形式的肿瘤抗原(包括:编码TAA的mRNA,新抗原的mRNA和次氯酸氧化肿瘤裂解物),并与其他免疫治疗药物(包括:抗程序性死亡受体1(PD-1)抗体、免疫佐剂聚肌苷酸胞苷酸(poly I:C)等)联合使用,以进一步增强抗肿瘤活性。虽然此前有III期临床研究应用抗PD-1纳武单抗联合放化疗治疗GBM,但未能达到提高总生存期的目标。本研究组合中,因成熟的DC细胞上调PD-L1和PD-L2,而且poly I:C激活免疫反应的同时也刺激PD-L1和PD-L2在GBM肿瘤细胞上的表达,因此有必要mRNA-DC肿瘤疫苗联合抗PD-1以促进纳武单抗阻断PD-L1/2在成熟DC细胞和GBM肿瘤细胞上的抑制信号被递送到T淋巴细胞。这是一种创新型的联合免疫治疗策略,在此之前尚无此种联合使用方式的报道。
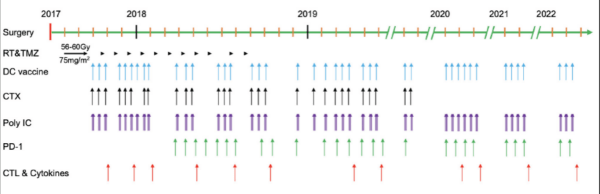
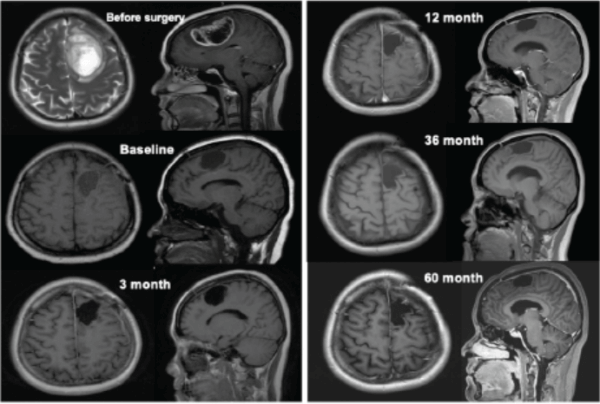
该患者的治疗过程从2017年7月至2022年9月,超过5年,其中包括42次mRNA-DC肿瘤疫苗(连同poly I:C,每次mRNA-DC疫苗接种后给药三次),以及抗PD-1药物和低剂量环磷酰胺(以清除调节性T细胞)。临床结果显示,综合免疫疗法诱导出强大的抗肿瘤CD4+和CD8+T细胞反应,且在整个治疗期间未观察到免疫治疗相关的不良事件。2022年7月21日的最近一次MRI扫描结果显示没有复发迹象。研究结果表明,整合到标准放化疗中的联合免疫疗法对于长期治疗GBM安全并有效。
值得关注的是,该临床研究除了采用全球首例mRNA-DC肿瘤疫苗/抗PD-1/poly I:C联合免疫治疗GBM以外,还使用了一项全新的TriVac技术对肿瘤抗原进行功能修饰。该项技术由美国杜克大学和约翰斯·霍普金斯大学的科学家们发明,是将肿瘤抗原与一个不稳定结构域(DD)融合,同时将肿瘤抗原插入全长的溶酶体相关膜糖蛋白1(LAMP-1)中,以分别增强主要组织相容性复合体(MHC)I类和II类抗原的呈递。临床研究中使用了7种TAAs,其中5种TAA(SOX11、PIM1、SP17、SOX3和CSPG4)的结果显示,第一阶段未经此技术修饰其诱导的抗原特异性T细胞反应相对较弱,而第二阶段经TriVac技术修饰后,诱导的抗原特异性T细胞反应大幅度增强。另外两种TAAs(MTFR2和ADAMTSL1)使用了TriVac技术修饰,用于治疗的第二阶段,诱导出非常强的抗肿瘤特异T淋巴细胞反应。此结果表明TriVac技术在本次临床试验中有突出表现。
另一个值得关注的发现是,通过研究对于mRNA编码TAAs的抗肿瘤实际应用有了新的认知。为了最大限度地提高患者治愈的可能性,本次临床研究使用了三种类型的肿瘤抗原(mRNA-TAAs,mRNA-新抗原和次氯酸氧化裂解物)来负载自体DC细胞。使用这些抗原可以极大的相互补充其在肿瘤疫苗中的作用。次氯酸氧化肿瘤裂解物具有增强免疫原性的作用,但受限于难以从肿瘤组织中获取足够量的肿瘤抗原长期使用。本研究中患者的次氯酸氧化肿瘤裂解物仅足以支撑三次免疫接种,无法长期治疗。相比之下,体外合成的mRNA编码TAA和新抗原可以提供无限量的供应。在GBM治疗中单独使用新抗原会有两个主要问题:第一,GBM较低的肿瘤突变负荷使可供选择的新抗原很少。本研究预测的10种新抗原中,仅有4种(PRKRIR,FLGN,HUWE1和RUNX1)产生了等于或大于野生型抗原诱导出的特异性T细胞反应,被用于负载自体DC细胞进行免疫治疗;第二,制造GMP级mRNA-新抗原并验证免疫原性需要花费时间较长,通常需要3~6个月,而本次研究中使用的TAAs可预先制备,成本也极大降低。TAA免疫原性通过使用TriVac技术修饰等方法可有效增强MHC I类和II类抗原呈递及T细胞刺激,远高于单独使用TAA,并在产品可及性上更具优势。因此,考虑联合使用mRNA-TAAs和mRNA-新抗原对于解决上述问题应是明智的选择。
论文作者在讨论中写道:“本病例研究中我们观察到几个新颖的方面。第一,本病例代表了GBM治疗中三种免疫治疗药物的首次联合研究。尽管此前三种免疫治疗药物均已在GBM的治疗中单独进行过测试,但全球范围内并没有关于三者联合使用的报道。第二,研究表明联合免疫疗法可以长期进行,并且安全性和有效性也得到了验证。本次研究的目的是测试联合免疫疗法的安全性和耐受性,并最大限度提高治愈的可能性。该患者超过5年的无进展生存期的研究结果令人鼓舞。第三,不同形式的肿瘤抗原,包括mRNA-TAA、mRNA-新抗原和次氯酸氧化肿瘤裂解物,用于诱导抗肿瘤T淋巴细胞反应,可以相互补充,促进肿瘤治疗性疫苗疗效。第四,基于TriVac技术的肿瘤抗原修饰技术表现出良好的安全性,并且在患者体内诱导出强大的抗肿瘤特异性CD4+和CD8+T细胞反应。”
10月13日,美国mRNA疫苗制造商Moderna宣布与制药企业默沙东合作,联合开发并销售一种个性化精准治疗癌症疫苗(PCV)mRNA-4157/V940,与默沙东的抗PD-1药物帕博利珠单抗(Keytruda,K药)联用,探索治疗高危黑色素瘤。10月16日英国《卫报》报道,德国生物技术公司BioNTech的创始人乌古尔﹒萨欣(Uğur Şahin)和奥兹朗﹒图雷利(Özlem Türeci)夫妻在接受BBC采访时表示,针对癌症的mRNA疫苗可能在2030年前上市。两条消息引发全球对于mRNA肿瘤疫苗的广泛关注。10月18日,国家药品监督管理局药品评审中心(CDE)官网信息,122cc太阳集成游戏生物科技(珠海)有限公司的靶向Survivin mRNA-DC细胞注射液临床试验申请(IND)已获受理(受理号:CXSL2200520),成为国内首个获得受理的脑胶质母细胞瘤治疗性mRNA疫苗。国内mRNA-DC肿瘤疫苗的研发进度已处于和国际巨头相当的水平。
未来攻克癌症的策略是需要进一步提高肿瘤mRNA疫苗的有效性和安全性,对于癌症等复杂性疾病,没有一种技术手段可以解决全部问题,多学科综合治疗(MDT)的模式值得重视,联合治疗是必走之路。
推荐文章
-
发布时间:2024-05-26
-
发布时间:2024-04-22
-
发布时间:2024-02-28
-
发布时间:2023-11-09








